C’est l’histoire d’un homme de 49 ans qui présente une hypersudation, des palpitations et une fatigue récurrente depuis près de cinq ans. Ces épisodes disparaissent complètement dès qu’il avale quelque chose. Au cours des quatre premières années, ces symptômes sont survenus environ une à trois fois par semaine. Ils étaient assez légers. Par négligence et du fait que ces symptômes s’estompaient totalement après avoir mangé, ce patient n’y a porté attention que lorsqu’ils sont devenus plus fréquents et se sont aggravés au cours de l’année écoulée.
Le patient s’est alors décidé à consulter dans une clinique qui se contente de déterminer la glycémie capillaire au bout du doigt. Celle-ci est basse. Elle fluctue entre 3 et 5 mmol/L chaque fois que les symptômes surviennent. Les valeurs normales sont comprises entre 3,3 et 5,5 mmol/L (60-100 mg/dL) à jeun. Les symptômes disparaissent chaque fois après que le patient a mangé, un comportement qui a fini par entraîner une prise de poids de 25 kg.
Quelques jours plus tard, le patient perd brutalement connaissance de bon matin et ne reconnaît plus son entourage. Il est alors adressé à l’hôpital le plus proche. Sa glycémie est alors très basse, à 1,7 mmol/L.
Les examens sanguins montrent un taux significativement élevé d’insuline et de peptide C lors des épisodes d’hypoglycémie. Le dosage du peptide C a pour but d’évaluer la sécrétion endogène d’insuline. On rappelle que l’insuline est sécrétée sous forme de pro-insuline, constituée d’une chaîne alpha et d’une chaîne bêta reliées par le peptide C. Des concentrations d’insuline et peptide C élevées sont les témoins d’une production trop importante d’insuline. On parle alors d’hyperinsulinisme endogène. Les médecins suspectent que ce patient est atteint d’insulinome, une tumeur rare des cellules bêta du pancréas qui sécrètent de l’insuline. Le principal symptôme est une hypoglycémie à jeun.
Ce patient mesure 1,72 m et pèse 115 kg. Son indice de masse corporelle (IMC) est de 38,8 kg/m², ce qui témoigne d’une obésité sévère. Ce quadragénaire ne présente pas d’antécédents de diabète, pas plus que dans son histoire familiale : ni ses parents, grands-parents, frères et sœurs n’ont souffert ou souffrent de cette pathologie.
Ce cas clinique est rapporté par des médecins chinois de l’hôpital universitaire de Changsha (province du Hunan) dans un article publié en février 2024 dans la revue Endocrine.
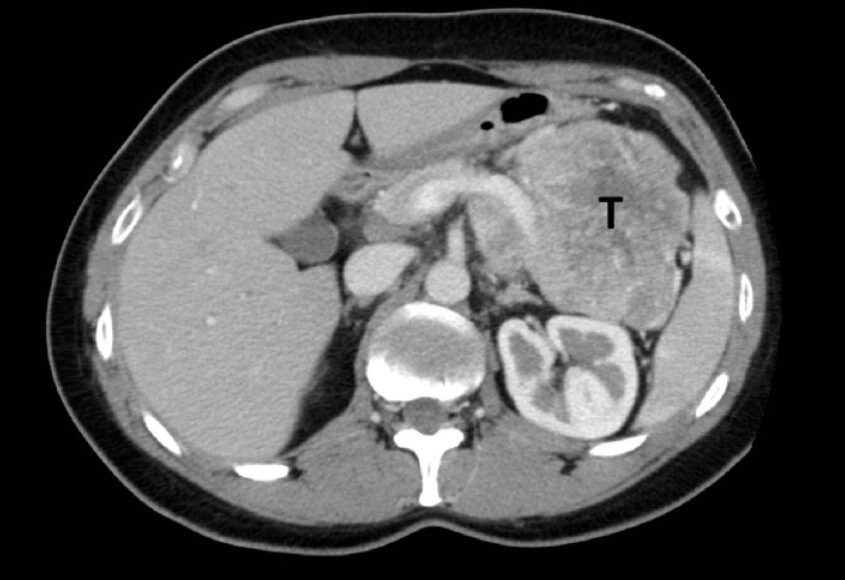
Le patient passe un scanner abdominal qui révèle la présence d’une lésion à la jonction entre la tête et le cou du pancréas, faisant fortement suspecter un insulinome. Il est opéré. Les chirurgiens procèdent à l’ablation d’une masse de 3 x 2,5 x 2 cm dans la partie moyenne du pancréas. L’examen immuno-histochimique de la pièce opératoire montre la présence de certains marqueurs neuroendocrines, notamment la chromogranine A et la synaptophysine.
Peu de temps après l’intervention chirurgicale, la glycémie du patient augmente brutalement, jusqu’à atteindre 20 mmol/L (soit 3,6 g/L). Les examens sanguins montrent l’absence d’auto-anticorps associés au diabète de type 1 (DT1).
Compte tenu des symptômes et des résultats des examens de laboratoire, les médecins évoquent le diagnostic d’insulinome et de diabète de type 2 (DT2). Le patient est immédiatement traité par insulinothérapie à la pompe. Une semaine après avoir été opéré, un traitement par antidiabétique oral est commencé, en même temps qu’il reçoit 40 UI (unités internationales) d’insuline par voie sous-cutanée avant le coucher.
Trois mois plus tard, le patient a perdu 12 kg. Sa glycémie à jeun est de 6,2 mmol/L, sa glycémie postprandiale à 9,4 mmol/L. La dose d’insuline sous-cutanée a été réduite à 8 UI.
Lors d’une seconde visite de suivi, trois mois plus tard, l’IMC du patient est à 31 kg/m². Le traitement par insuline est interrompu. Le patient est alors uniquement sous antidiabétiques oraux.
Lorsque le patient est revu neuf mois après l’intervention chirurgicale, il a perdu au total 25 kg. Son diabète est bien équilibré, avec une glycémie à jeun à 5,4 mmol/L et une glycémie postprandiale à 7,8 mmol/L. Le patient ne fait plus d’épisodes hypoglycémiques.
Il a donc présenté un insulinome, qui est une tumeur endocrine pancréatique rare. On estime l’incidence entre 1 à 4 cas par an pour un million d’individus. La tumeur est bénigne dans 90 % des cas. Elle survient le plus souvent dans la cinquième ou sixième décennie de vie.
L’insulinome pose le plus souvent un problème de diagnostic topographique en raison de la petite taille de la tumeur (inférieure à 2 cm dans 90 % des cas). Celle-ci se manifeste par une hypersécrétion d’insuline, à l’origine de ce que l’on appelle une hypoglycémie hyperinsulinémique.
La chute de la glycémie se traduit par un ensemble de sensations liées à une activation globale du système nerveux sympathique (autonome) : tremblements, palpitations, transpiration (diaphorèse), sensation de faim entraînant une hyperphagie. D’autres symptômes sont, eux, la conséquence directe du manque du substrat énergétique au niveau cérébral. On parle de symptômes neuroglycopéniques, qui incluent la fatigue et des changements de comportement.
Entre 20 % et 40 % des patients atteints d’insulinome sont en surpoids. La tumeur peut être isolée, ou s’intégrer dans le cadre de plusieurs pathologies endocriniennes (endocrinopathies multiples type 1, NEM 1). Les formes malignes sont observées seulement dans 10 % à 12 % des cas, avec des métastases siégeant le plus souvent dans le foie et les ganglions lymphatiques.
Le diagnostic d’insulinome en cas de diabète est un défi
L’hypoglycémie est le symptôme le plus fréquent. Le diagnostic est difficile en raison de manifestations cliniques quelquefois atypiques. En effet, de nombreux patients sont asymptomatiques et ne présentent pas d’hypoglycémie au moment du bilan.
Le diagnostic d’insulinome est suspecté sur la présence de ce que l’on appelle la triade de Whipple, à savoir une glycémie inférieure à 0,50 g/L au moment des symptômes, des symptômes neuroglycopéniques et leur soulagement immédiat après administration de glucose.
Le diagnostic est confirmé par des analyses biologiques comprenant une épreuve de jeûne de 72 heures (avec dosage de l’insuline, du peptide C et de la pro-insuline pendant les épisodes hypoglycémiques). Lors de ce jeûne, on réalise un dosage sanguin de l’insuline et du peptide C. On observe une augmentation significative des concentrations d’insuline sérique et du peptide C lors d’un jeûne prolongé pendant l’épisode d’hypoglycémie, ce qui témoigne d’un hyperinsulinisme endogène. Chez les patients atteints d’insulinome, les taux élevés d’insuline et de peptide C sont inappropriés par rapport à la glycémie (ratio insuline/peptide C > 1,0).
Le traitement de l’insulinome repose sur l’ablation chirurgicale
Le traitement de l’insulinome repose uniquement sur l’ablation chirurgicale de la tumeur. La résection chirurgicale est souvent curative.
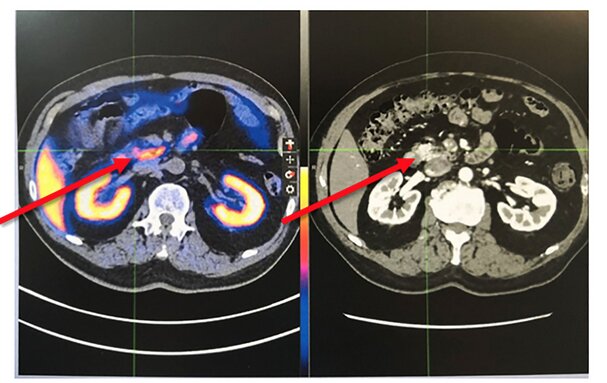
La localisation précise de l’insulinome est une étape cruciale pour guider l’approche chirurgicale. Les techniques d’imagerie, telles que l’échographie abdominale, le scanner, l’imagerie par résonance magnétique (IRM), permettent de localiser la lésion tumorale. Les très petites tumeurs peuvent être localisées par des techniques (tomographie par émission de positons) reposant sur l’emploi d’isotopes marqués au 68Ga-DOTATATE, qui permet de localiser les récepteurs de la somatostatine chez les patients atteints d’une tumeur neuroendocrine.
En cas d’insulinome malin, d’autres thérapeutiques peuvent être proposées : résection chirurgicale agressive avec ablation étendue du foie et du pancréas, octréotide (médicament inhibiteur de la libération d’insuline), chimiothérapie.
L’association d’un insulinome et d’un diabète est exceptionnelle
L’insulinome est extrêmement rare chez les patients vivant avec un diabète. Dans la plupart des cas, le diabète est un DT2, très rarement un diabète de type 1 (DT1). Sur la cinquantaine de cas d’insulinome décrits dans la littérature survenant chez des patients ayant un diabète, seuls 5 avaient un DT1, les autres étaient des diabétiques de type 2 (DT2). Par ailleurs, on ne compte dans la littérature médicale qu’une vingtaine de cas d’association d’un insulinome malin et d’un diabète.
Une étude américaine de la Mayo Clinic a ainsi montré que parmi 313 individus atteints d’insulinome entre 1927 et 1992, seul un patient présentait un diabète préexistant. De même, dans une cohorte japonaise de 443 cas d’insulinome observés entre 1976 et 1990, un seul patient était diabétique. Une étude taïwanaise a détecté un seul patient diabétique parmi 23 cas d’insulinome observés entre 1984 et 2006 dans un centre hospitalier. Enfin, on a dénombré la survenue de seulement 13 cas d’insulinome métastatique chez des patients avec un diabète préexistant au cours de ces cinquante dernières années.
En 2020, des chirurgiens grecs ont rapporté le cas d’une femme de 62 ans diagnostiquée comme porteuse d’un insulinome dans le cadre de la « guérison » de son diabète. Cette femme obèse, vivant avec un diabète de type 2 (DT2) depuis 15 ans et traitée par deux antidiabétiques oraux, a soudainement présenté des épisodes d’hypoglycémie, avec confusion, perte de connaissance, vision trouble et faiblesse. Le traitement antidiabétique a été interrompu.
Une « disparition » inattendue du diabète
Curieusement, sa glycémie est revenue à la normale alors qu’elle avait cessé de prendre tout traitement antidiabétique pendant trois mois. Après quoi, elle a commencé à présenter fréquemment de légers épisodes hypoglycémiques. Les patients avec un diabète de type 2 présentent une résistance à l’insuline, ce qui peut expliquer qu’en cas de survenue d’un insulinome, ces mêmes personnes puissent ne pas présenter les symptômes typiques d’une hypoglycémie. Par ailleurs, l’obésité s’accompagne d’une résistance à l’insuline et l’hyperinsulinisme, en entraînant une prise de poids, augmente cette résistance.
Le diagnostic d’insulinome a été confirmé par des analyses biologiques sanguines comprenant une épreuve de jeûne de 72 heures. Le scanner a permis de localiser une grosse tumeur pancréatique de la tête du pancréas. La patiente a subi l’ablation du pancréas et du duodénum, en préservant le pylore.
Suite à l’intervention, le diabète est revenu. Plus précisément, la patiente n’a plus connu de normalisation de sa glycémie. En période post-opératoire, la glycémie a ainsi significativement augmenté, passant de 1,62 g/L à 2,1 g/L, ce qui a imposé de mettre la patiente sous perfusion intraveineuse d’insuline. L’insulinothérapie a été interrompue sept jours plus tard, la patiente reprenant un traitement antidiabétique par voie orale pour contrôler la glycémie. Elle n’a pas refait d’épisode hypoglycémique l’année suivante.
En 2008, des diabétologues strasbourgeois ont rapporté dans les Annales d’Endocrinologie la survenue d’hypoglycémies récurrentes dues à un insulinome malin chez une femme dont le diabète de type 2 était correctement équilibré pendant des années avec le même traitement antidiabétique oral. Cette patiente de 79 ans a vu son hémoglobine glyquée (HbA1c) passer de 7,8 % à 5,8 % après le début des hypoglycémies à répétition. Celles-ci sont devenues progressivement sévères, malgré la diminution, puis l’arrêt, du traitement antidiabétique oral.
L’association à un diabète retarde le diagnostic d’insulinome
Même si l’insulinome constitue une cause excessivement rare d’hypoglycémie chez un patient ayant un diabète, il est important de ne pas passer à côté du diagnostic. En effet, l’association à un diabète retarde le diagnostic d’insulinome, même s’il n’altère pas le pronostic lorsque la tumeur est bénigne. Un délai compris entre 6 et 36 mois entre les premiers symptômes et le diagnostic a été décrit dans la littérature.
Une hypoglycémie récurrente chez un patient diabétique peut en effet être interprétée à tort comme une amélioration du contrôle glycémique sous traitement. Le diagnostic d’insulinome doit être évoqué en particulier chez les patients qui font des épisodes hypoglycémiques alors qu’ils ne reçoivent qu’un traitement antidiabétique léger, ainsi que chez ceux qui présentent des épisodes hypoglycémiques alors qu’ils ne sont pas traités par insuline. Il convient donc d’insister sur la nécessité d’explorer une hypoglycémie récurrente chez un patient diabétique et de ne pas mettre les épisodes hypoglycémiques trop facilement sur le compte d’un problème lié au traitement (surdosage médicamenteux).
Quand l’insulinome démasque l’existence d’un diabète
On le voit, la coexistence d’un insulinome et d’un diabète est extrêmement rare, la probabilité pour que ces deux pathologies surviennent chez un même individu étant très faible. Il est encore plus rare qu’un diabète soit découvert après chirurgie pour un insulinome. Dans un tel cas, la tumeur pancréatique démasque la maladie diabétique qui n’est diagnostiquée qu’après la résection chirurgicale de la tumeur. La survenue d’une hyperglycémie persistante suite à l’ablation de l’insulinome indique un diabète sous-jacent.
En 2012, des endocrinologues turcs dans la revue Diabetic Medicine ont rapporté un cas de diabète de type 2 découvert chez une femme de 45 ans qui avait été opérée pour un insulinome malin.
Chez cette patiente, une hyperglycémie est survenue après résection chirurgicale de la tumeur (énucléation), qui a nécessité une insulinothérapie par voie sous-cutanée en post-opératoire pendant trois semaines, puis un traitement permanent par des antidiabétiques oraux.
Il est possible que cette patiente ait développé un diabète du fait de la survenue d’une insulino-résistance induite par une hyperphagie provoquée par les hypoglycémies à répétition. La patiente avait grossi de 20 kg en l’espace de cinq ans (101 kg, IMC à 39 kg/m²). Son diabète a été masqué pendant plusieurs années par l’insulinome et n’est devenu manifeste qu’après l’ablation de la tumeur. Il s’agit de l’unique cas de DT2 décrit après chirurgie pour un insulinome malin.
Que retenir pratiquement de ces cas cliniques exceptionnels ? Tout simplement que même si la coexistence d’un insulinome (responsable d’épisodes hypoglycémiques récurrents) et d’un diabète (associé à une hyperglycémie à jeun et postprandiale) peut sembler contradictoire, ces deux pathologies peuvent être présentes chez un même patient.
On ignore s’il existe une relation pathologique entre insulinome et diabète, même si plusieurs études datant des années 1960 et 1970 ont indiqué une association entre insulinome et antécédents familiaux de diabète. Pour autant, à ce jour, l’existence d’une corrélation positive entre ces deux pathologies n’a pu être établie. En effet, une augmentation de l’incidence de l’insulinome n’a pas été rapportée chez les patients vivant avec un diabète par rapport aux individus non-diabétiques, dans la mesure où l’on compte des millions de diabétiques dans le monde mais qu’un tout petit nombre de cas d’insulinome chez des patients diabétiques.
Marc Gozlan (Suivez-moi sur X, Facebook, LinkedIn, Mastodon, Bluesky)